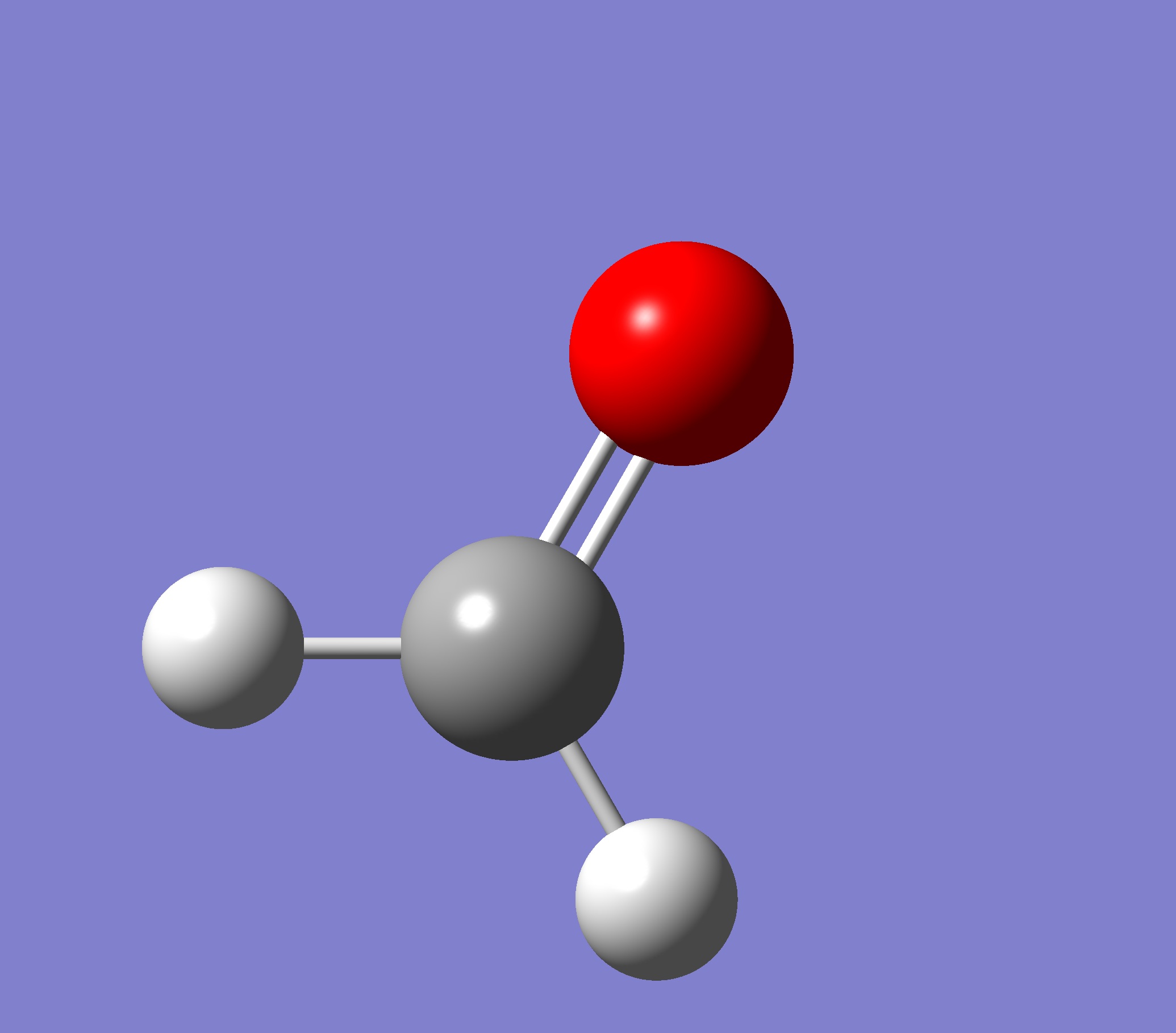
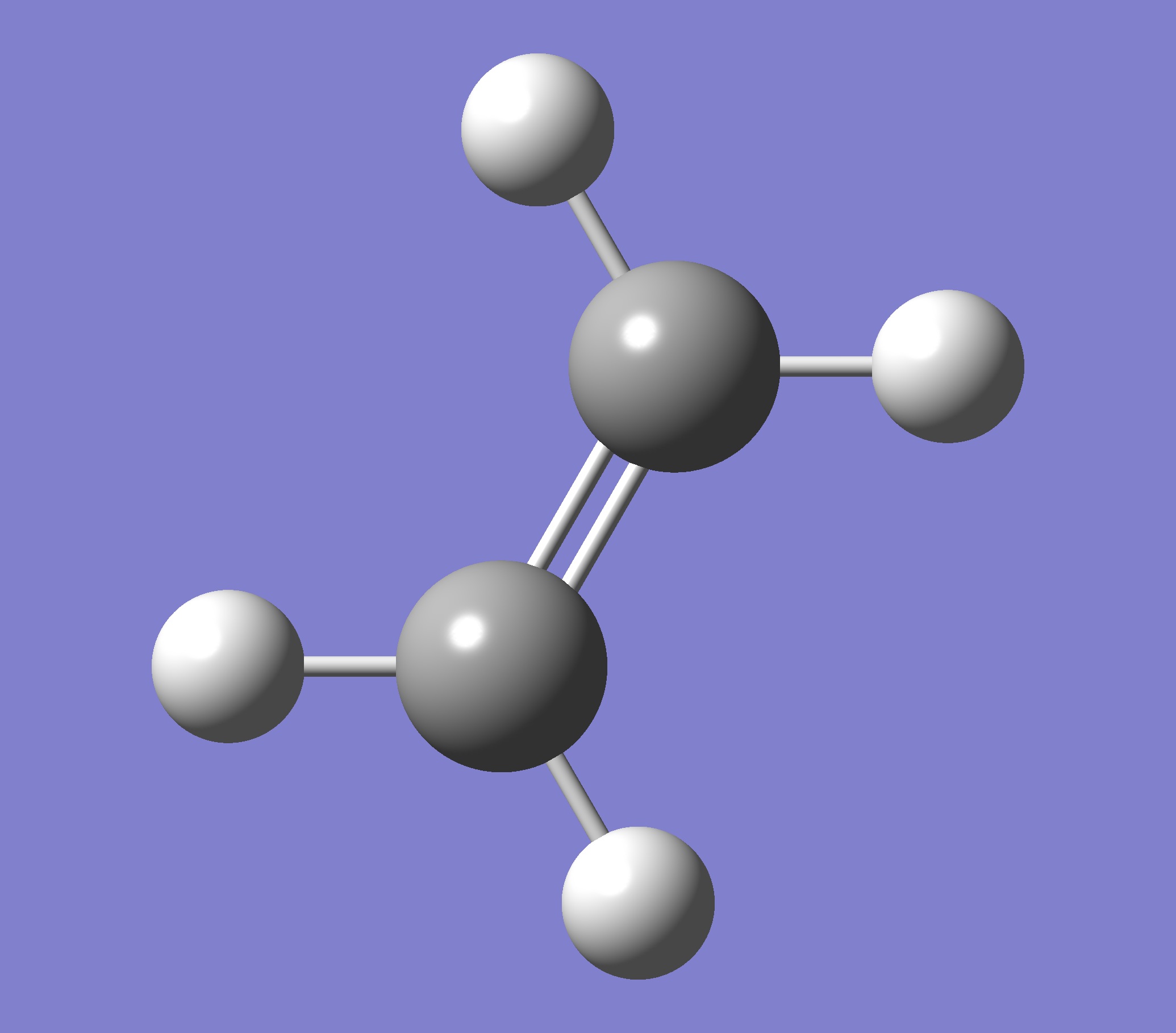
Getting Started with Calculations
comparing ethylene and formaldehyde
乙烯(ethylene)和甲醛(formaldehyde)擁有相同的總電子數 16e
甲醛 乙烯


計算法
B3LYP/6-311+G(2d,p)
軌域混成
甲醛 orbital 乙烯
 LUMO 9
LUMO 9
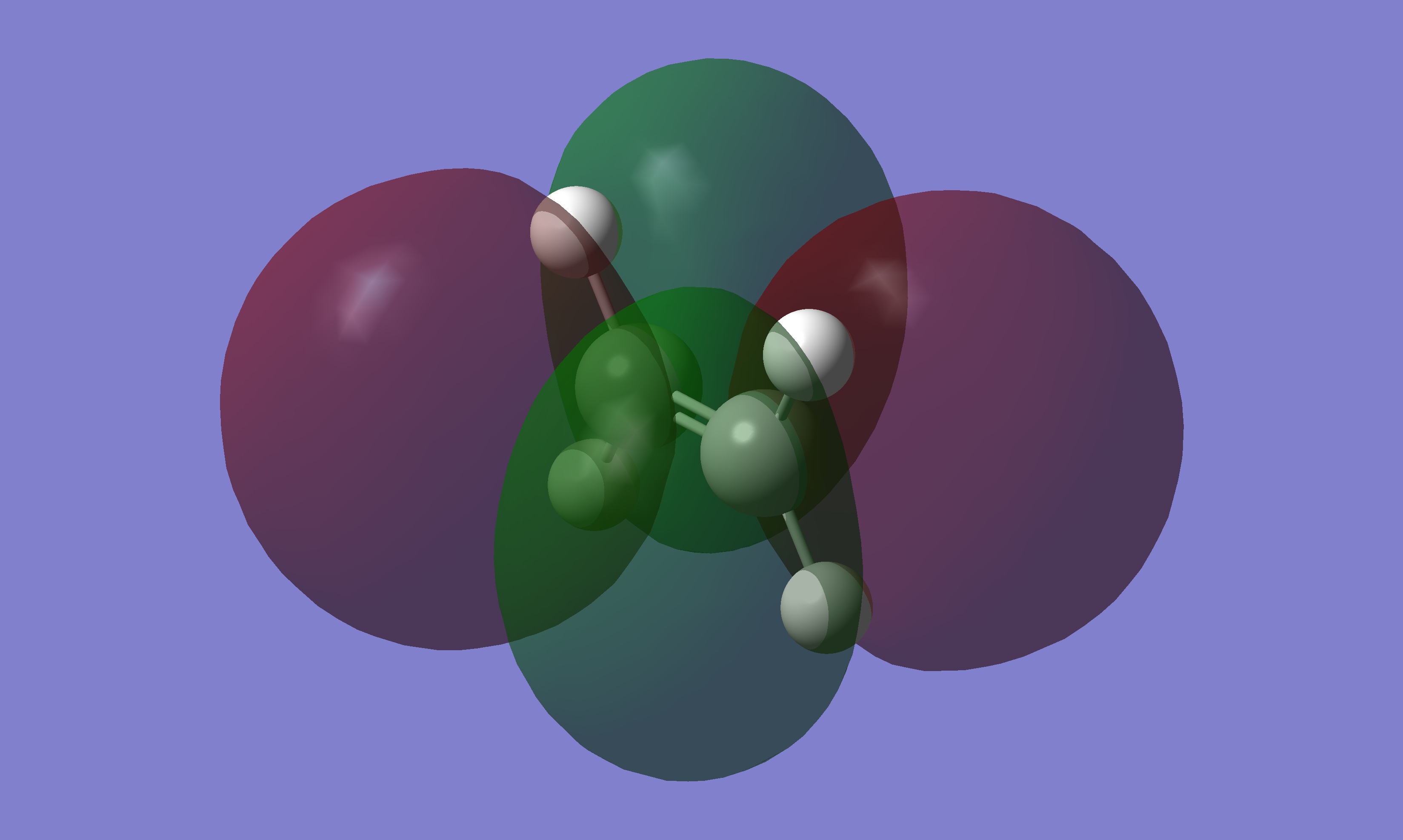
甲醛和乙烯的 LUMO 由氧或碳的 Px orbitals 組成,因為同邊的軌域標記的顏色不同,軌域無法混成
 HOMO 8
HOMO 8
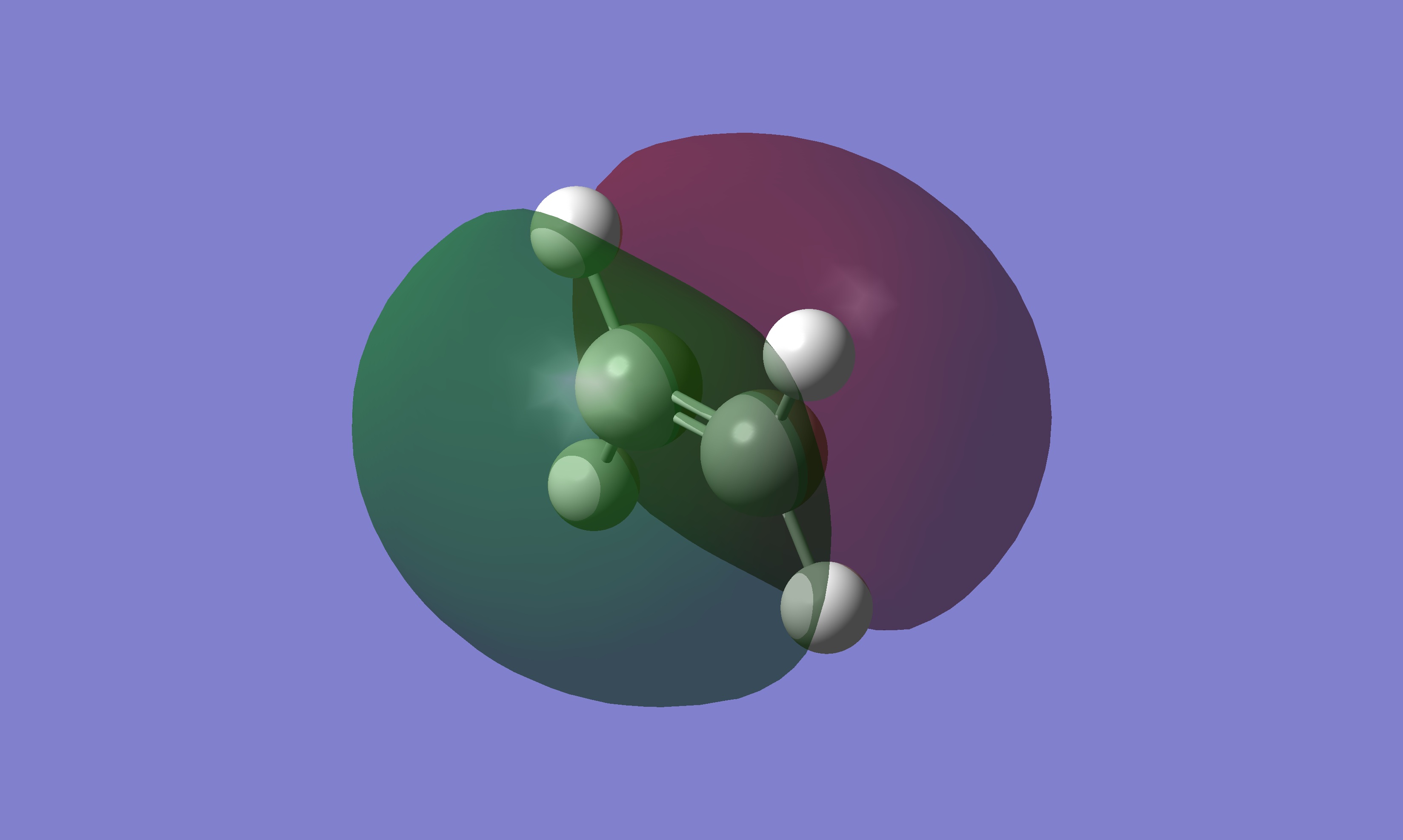
甲醛的 HOMO 由氧的 Py orbitals 和碳的 Py orbitals 跟氫的 s orbitals 混成軌域組成,同邊的軌域標記的顏色不同,軌域無法混成
乙烯的 HOMO 由碳的 Px orbitals 組成,同邊的軌域標記的顏色相同,軌域能混成
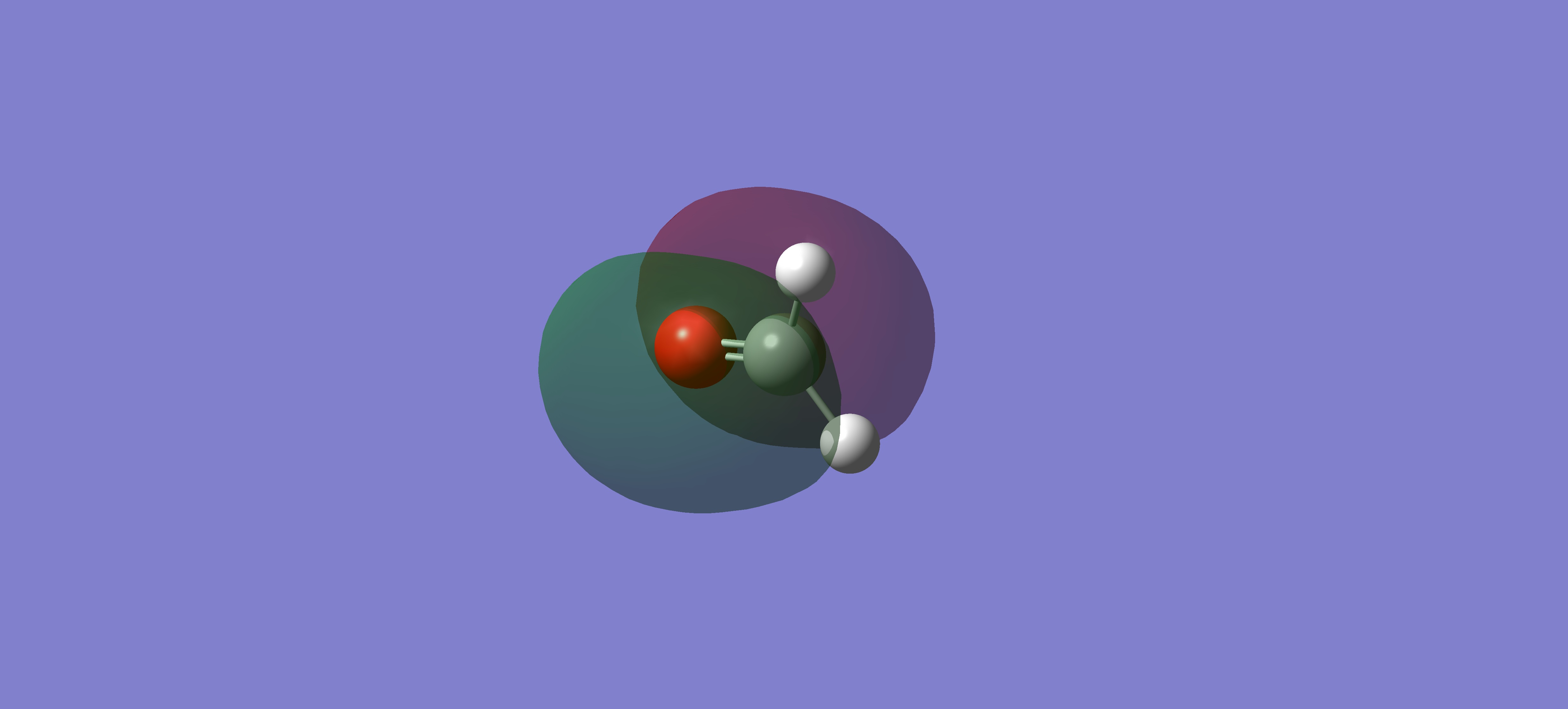
HOMO -1 7
甲醛的 HOMO -1 由氧和碳的 Px orbitals 組成,同邊的軌域標記的顏色相同,軌域會混成
甲醛的 LUMO 9 和 HOMO -1 7 氧和碳都是 Px orbitals,HOMO -1 7 orbitals,同邊的軌域標記的顏色相同能混成,形成 bonding π molecular orbital,LUMO 9 orbitals,同邊的軌域標記的顏色不同無法混成,形成 antibonding π* molecular orbital
甲醛的氧上有兩個未鍵結電子對,認為他們不參與分子軌域的形成,保持孤立原子時候的能階,軌域稱為非鍵軌域,軌域能量小於 LUMO 9 orbitals 的 antibonding π* molecular orbital,但高於 HOMO -1 7的 bonding π molecular orbital ,所以位在 HOMO 8
乙烯的 LUMO 9 和 HOMO 8 碳都是 Px orbitals,HOMO 8 orbitals,同邊的軌域標記的顏色相同能混成能混成,形成 bonding π molecular orbital,LUMO 9 orbitals,同邊的軌域標記的顏色不同無法混成,形成 antibonding π* molecular orbital
Dipole Moment
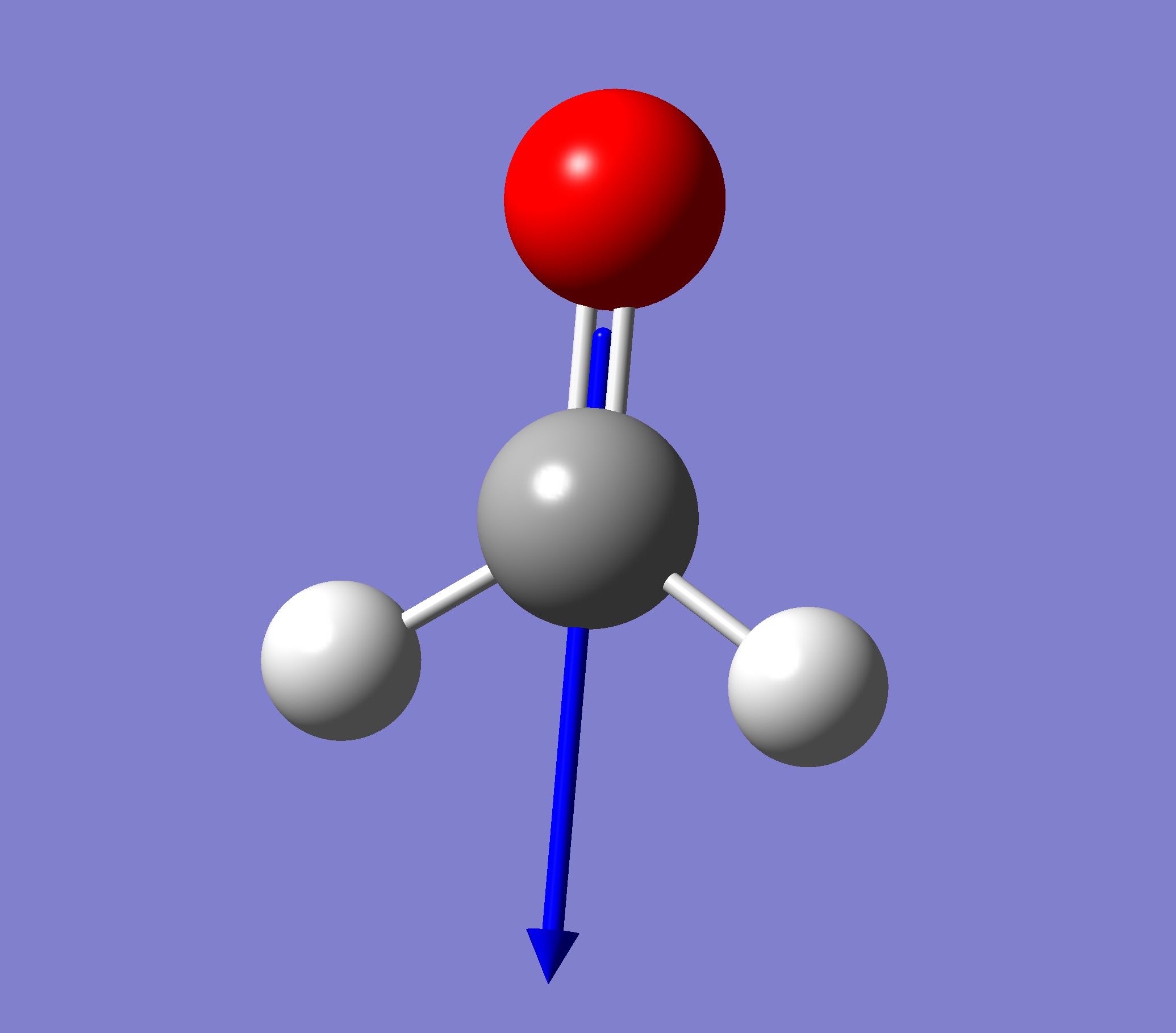

甲醛 乙烯
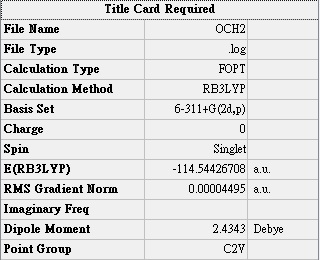
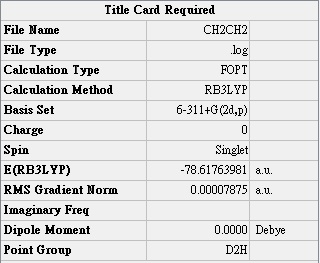
實驗值(Debye): 2.33168 0.0
甲醛的氧的偶極距向量的值大於碳和氫的總偶極距向量並且方向相反,所以淨偶極距不為 0
乙烯雙鍵兩邊的碳和氫的總偶極距向量的值相同但方向相反,所以淨偶極距為 0
(因為計算的偶極距用正值表示,所以圖中標示的偶極距向量向正值方向)
Point Group
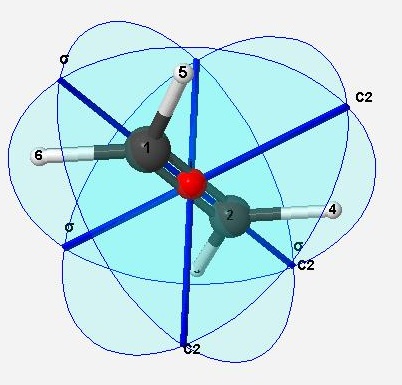 乙烯
乙烯
主旋轉軸為 C2
有一個 C2 旋轉軸垂直於主旋轉軸,所以為 D2
有對稱面σ垂直於主旋轉軸,所以 point group 為 D2h
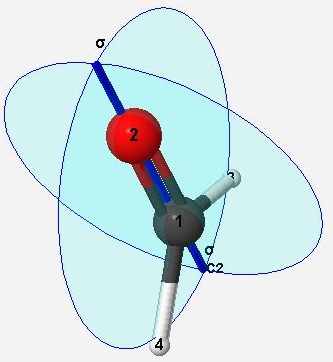 甲醛
甲醛
主旋轉軸為 C2
只有主旋轉軸,沒有對稱面σ垂直於主旋轉軸,所以 point group 為 C2v
原子帶的電荷
甲醛 乙烯
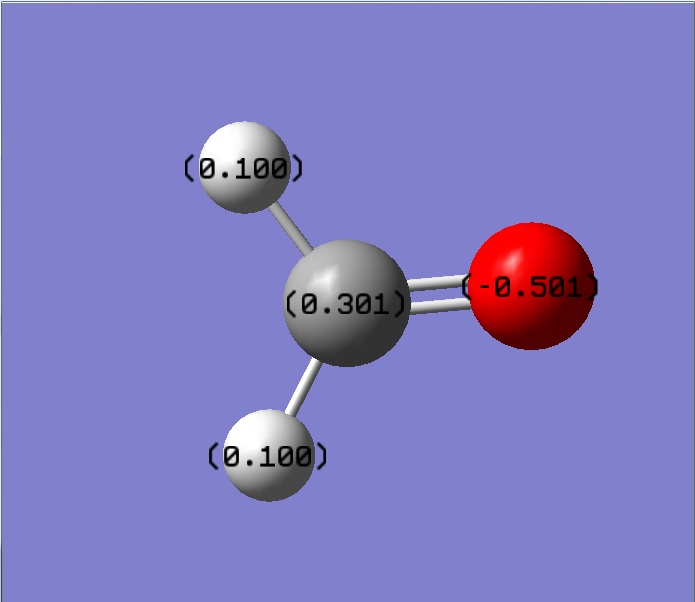
甲醛的氧的陰電性比碳和氫大,氧拉走鍵結的碳的電子,使得碳帶正電荷,氧則帶負電荷,碳的陰電性比氫大,氫會被鍵結的碳拉走電子,氫帶正電荷
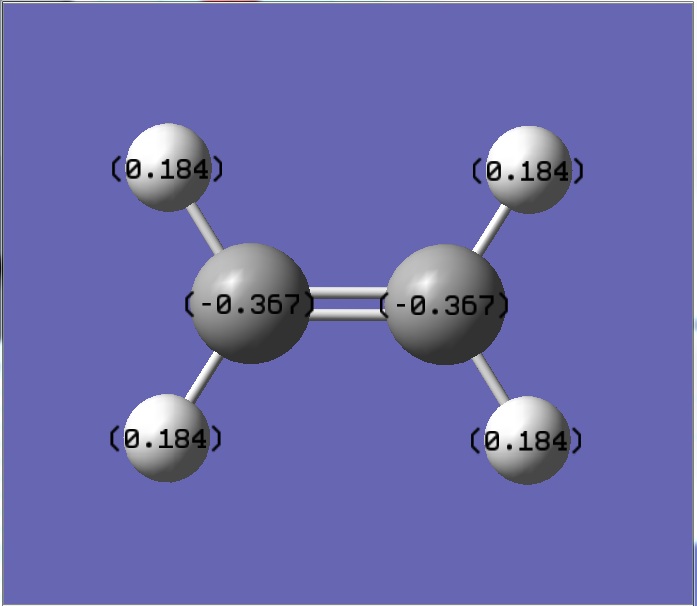
乙烯陰電性較大的是碳,碳拉走鍵結的氫的電子,使得碳帶負電荷,氫則帶正電荷,因為和主要拉電的負電荷的碳直間鍵結,所以氫的正電荷比甲醛的氫來的大,乙烯雙鍵兩邊的碳都是相同結構,所以碳的電荷會相同
(甲醛和乙烯的靜電荷為零,因為只取到小數點後三位,小數點後第四位四捨五入,所以圖上的淨電荷會有不為零的狀況)
鍵長和鍵角
甲醛 乙烯
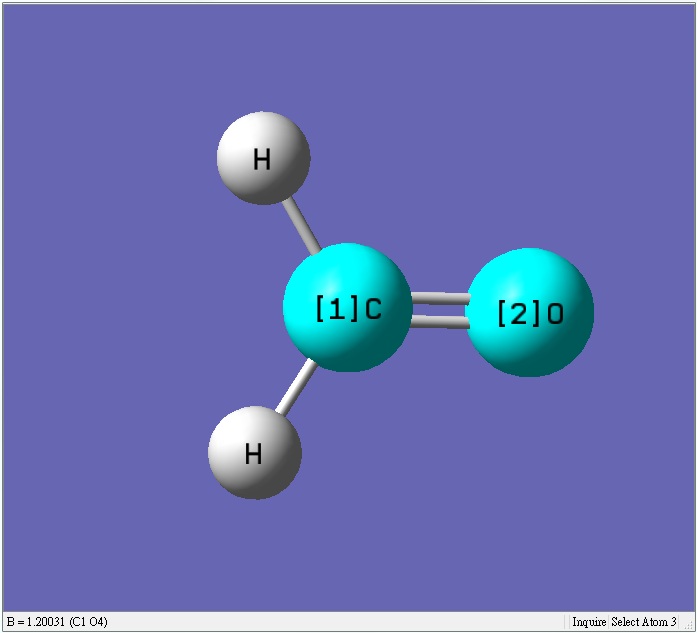

甲醛的氧的陰電性比碳強,會把鍵結的碳拉近一些使鍵長變短
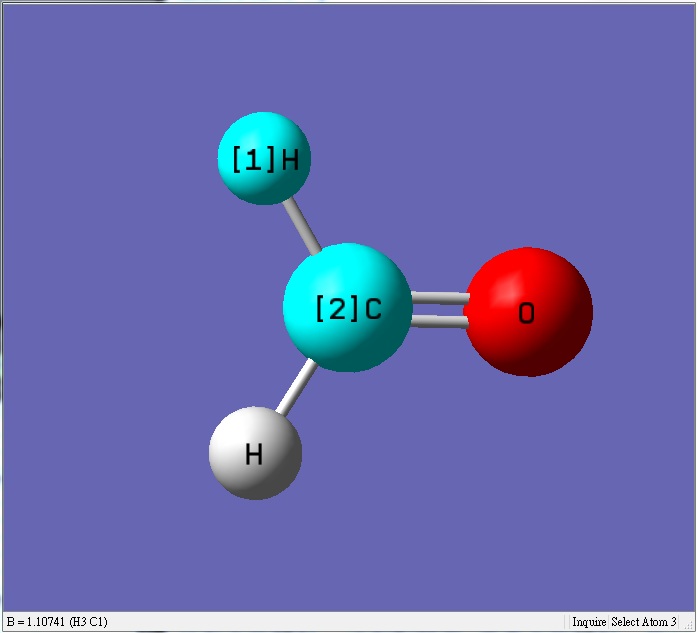
甲醛的碳的電子被鍵結的氧拉走,使得甲醛的碳比乙烯的碳帶更多正電荷,碳跟鍵結的氫會有較大的排斥力使得鍵長較長
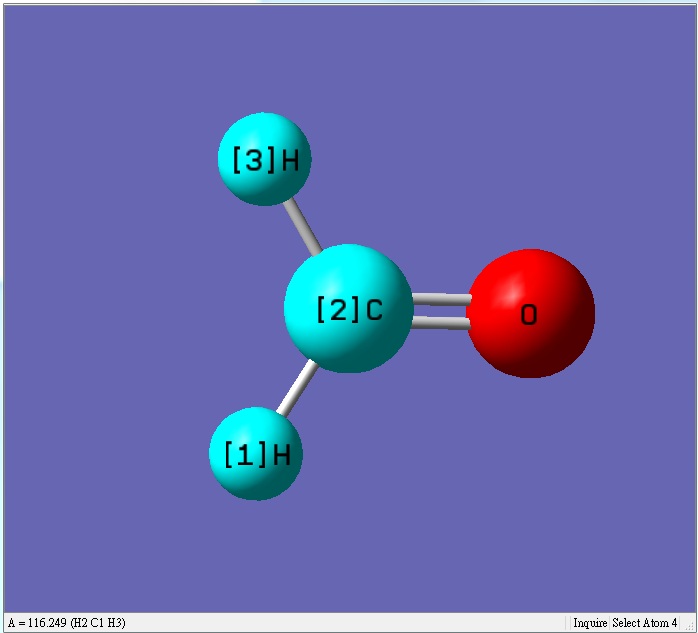
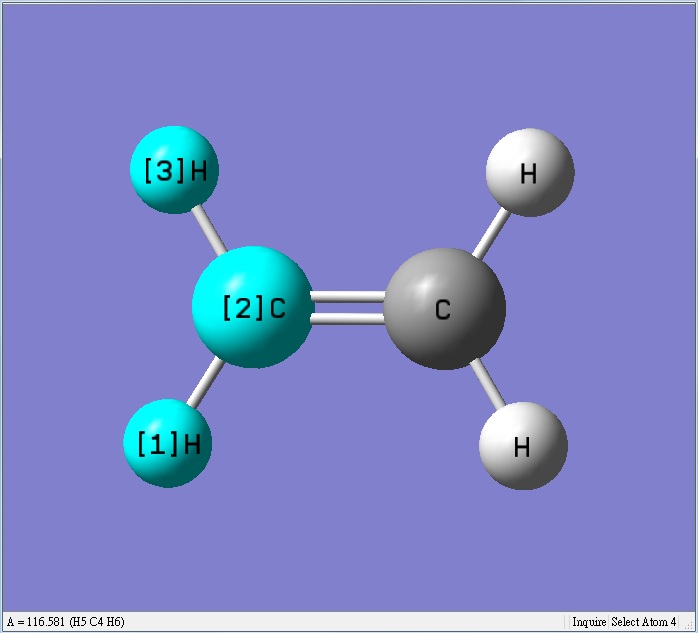
甲醛的碳氫鍵長變長,氫的正電荷變小,使得氫和氫之間的排斥力變小,可以靠較近,讓氫和氫的鍵角變小
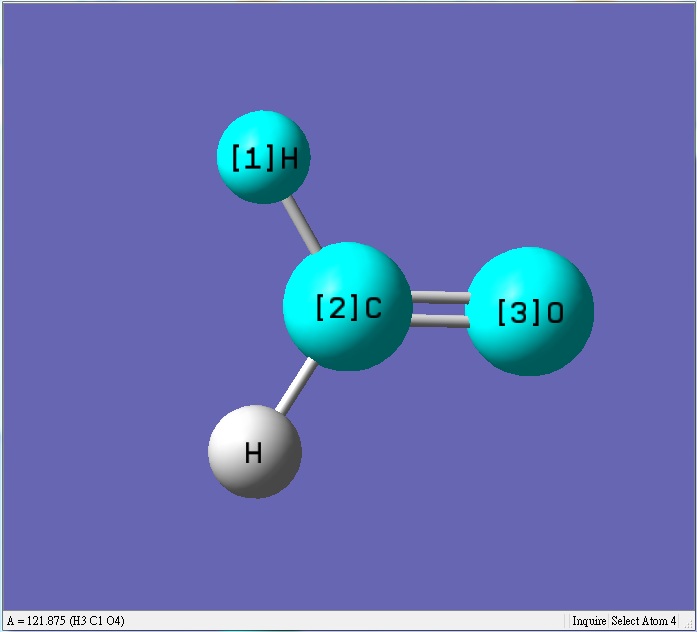
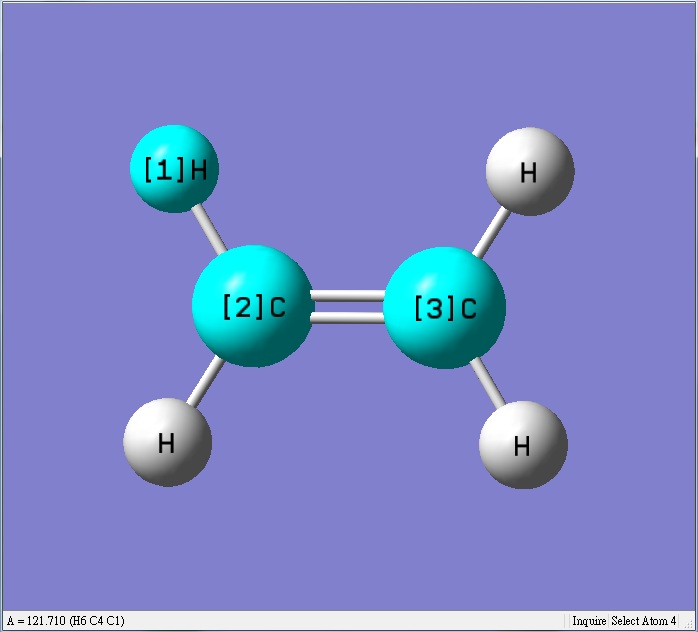
甲醛為平面sp2混成,氫和氫的鍵角變小,相對氫和氧的鍵角會變大